化学夏期講習 (12) p-23 p-24
「凝固点降下・二量体」


le 10 août, 2022
化学夏期講習 (12) p-23 p-24
「凝固点降下・二量体」


ちょっと電子論もどきの解説 わかりやすくをモットーに,すこしあやしいですが G le 11 août ,2022
<安息香酸とその二量体>
安息香酸はベンゼン環をもつ,芳香族カルボン酸で,白色固体ですが,化学式を見るとわかるように
脂肪族の酢酸やギ酸と同じに,カルボキシ基-COOHという原子団(基)をもっています。
カルボキシ基という名称は,カルボニル基とヒドロキシ基を合わせたものです。
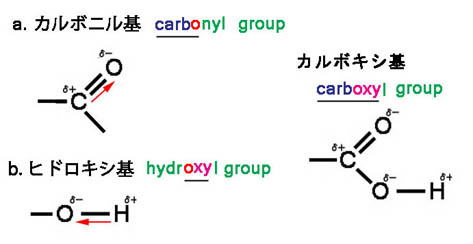
上図に示すように,電気陰性度の差からO-H間は,Oがδ-,Hがδ+となって分極しています。
また,C=O間も差は大きくないものの,他の効果もあって同様に分極しています。
そこで,カルボキシ基どうしが下図のように向き合うと,2本の水素結合が生じて,二量体を作ります。
※ 二量体の構造式を書かせる入試問題もあった
ベンゼンなど,無極性の有機溶媒中では,極性のある部分を内側にして,二量体を作りやすいのです。
ですから,酢酸も有機溶媒中や気体となった場合,二量体を作ると考えられます。
石鹸分子は水(極性溶媒)中では極性部分を外側にしてミセルコロイドを作ります。それと同様に,
極性部分を内側に向け,溶媒に似た無極性部分を外側に向け,溶媒和しやすくなっているのです。
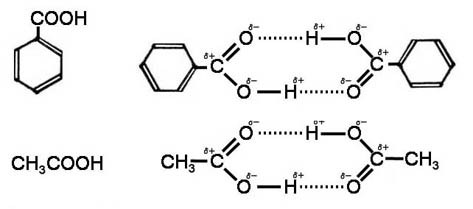
<カルボニル基の分極>
酢酸や安息香酸のように,カルボキシ基をもつ化合物をカルボン酸といいます。
有機化学の単元で学ぶ予定ですが,水溶液では弱酸としてはたらき,また,エステル化やアミド化,
あるいは,その逆の加水分解といった特有の反応をします。
そうした反応のきっかけを作るのが,カルボニル基の立ち上がりerection ちょいえち^^);;と呼ばれる現象です。
極性溶媒中で,二重結合のπ電子雲がさらにO側に移動し,強く+,-に分極するのです。
すると,反応物が陽イオンならO原子と,反応物が陰イオンならC原子と反応しやすくなるというわけです。
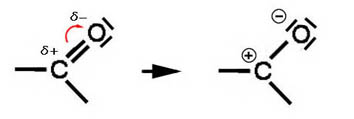
<カルボン酸の電離とイオン>
酢酸などの電離。弱酸としてはたらくわけ。
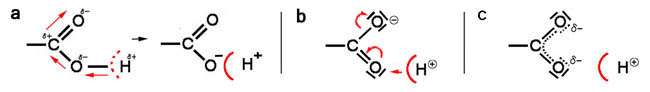
a 単純に考えてみましょう。まず,O-H間ではO側に共有電子対がひきつけられています。そこに,カルボニル
のOが引き付ける効果がプラスされると,O-H間の分極はさらに進み,HはついにOに電子をわたして,裸に
なり,H+ としてとれていくでしょう。H+は naked proton と呼ばれる 笑
これは,主にσ結合の上での話となります。実際には周りのH2O分子のpush-pullの効果も加わる
b π電子の動きも含め,先のカルボニルの効果をこれに加えると,さらにH+は出やすくなり,bの極限構造式を
もつ陰イオンが生じます。
c 分子やイオンの構造でも触れたように,実際のカルボン酸の陰イオンでは,C原子はsp2混成をとり,π電子
雲は2つのO原子との間に均等に広がると考えられ,実際に近い表現では,c図のようになると考えられます。